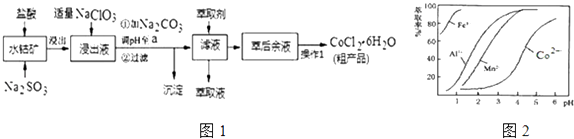
已知:①浸出液中含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见表:(金属离子浓度为:0.01mol/L)
沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
③CoCl2•6H2O熔点为86℃,加热至110~120℃时,失去结晶水生成无水氯化钴.
A.2.0~2.5 B.3.0~3.5 C.4.0~4.5 D.5.0~5.5
①该反应的气体产物是CO2 .
②该反应的气体产物是CO.
③该反应的气体产物是.
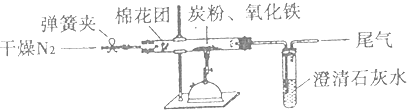
如图所示,将一定量的氧化铁在隔绝空气的条件下与过量炭粉完全反应,测定参加反应的碳元素与氧元素的质量比.
查阅资料
氮气不与碳、氧化铁发生反应.实验室可以用氯化铵饱和溶液和亚硝酸钠(NaNO2)饱和溶液混合加热反应制得氮气.请写出该反应的离子方程式:.
①按如图连接装置,并检查装置的气密性,称取3.20g氧化铁、2.00g碳粉混合均匀,放入10.38g的硬质玻璃管中;
②加热前,先通一段时间纯净干燥的氮气;
③停止通入N2后,夹紧弹簧夹,加热一段时间,澄清石灰水(足量)变浑浊;
④待反应结束,再缓缓通入一段时间的氮气.冷却至室温,称得硬质玻璃管和固体总质量为53.02g;
⑤过滤出石灰水中的沉淀,洗涤、烘干后称得质量为1g.步骤②、④中都分别通入N2 , 其作用分别为.
试根据实验数据分析,写出该实验中氧化铁与碳发生反应的化学方程式:.
学习小组有同学认为应对实验装置进一步完善.
①甲同学认为:应将澄清石灰水换成Ba(OH)2溶液,其理由是.
②从环境保护的角度,请你再提出一个优化方案:.
已知:H2的燃烧热为285.8kJ•mol﹣1
N2(g)+2O2(g)═2NO2(g)△H=+133kJ•mol﹣1
H2O(g)═H2O(l)△H=﹣44kJ•mol﹣1
催化剂存在下,H2还原NO2生成水蒸气和其他无毒物质的热化学方程式为:.
向2L密闭容器中加入2molCO2和6molH2 , 在适当的催化剂作用下,发生反应:CO2(g)+3H2(g)⇌CH3OH(l)+H2O(l)
①该反应自发进行的条件是(填“低温”、“高温”或“任意温度”)
②下列叙述能说明此反应达到平衡状态的是.(填字母)
a.混合气体的平均式量保持不变 b.CO2和H2的体积分数保持不变
c.CO2和H2的转化率相等 d.混合气体的密度保持不变
e.1molCO2生成的同时有3mol H﹣H键断裂
③CO2的浓度随时间(0~t2)变化如图1所示,在t2时将容器容积缩小一倍,t3时达到平衡,t4时降低温度,t5时达到平衡,请画出t2~t6CO2浓度随时间的变化.
反应时间 | CO2(mol) | H2(mol) | CH3OH(mol) | H2O(mol) | |
反应Ⅰ:恒温恒容 | 0min | 2 | 6 | 0 | 0 |
10min | 4.5 | ||||
20min | 1 | ||||
30min | 1 | ||||
反应Ⅱ:绝热恒容 | 0min | 0 | 0 | 2 | 2 |
①达到平衡时,反应Ⅰ、Ⅱ对比:平衡常数K(I) K(II)(填“>”“<”或“=”下同);平衡时CH3OH的浓度c(I) c(II).
②对反应Ⅰ,前10min内的平均反应速率v(CH3OH)=.在其他条件不变的情况下,若30min时只改变温度T2℃,此时H2的物质的量为3.2mol,则T1T2(填“>”、“<”或“=”).若30min时只向容器中再充入1molCO2(g)和1molH2O(g),则平衡移动(填“正向”“逆向”或“不”).
①电极2的电极反应式是;
②在标准状况下,当电极2室有11.2L CO2反应. 理论上电极1室液体质量(填“增加”或“减少” g.
![]() +CO
+CO
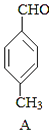
B
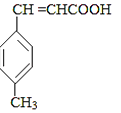
E
已知:HCHO+CH3CHO CH2═CHCHO+H2O
a.溴水 b.银氨溶液 c.酸性KMnO4溶液 d.新制Cu(OH)2悬浊液