①硬度大 ②密度小 ③易导电 ④耐腐蚀.
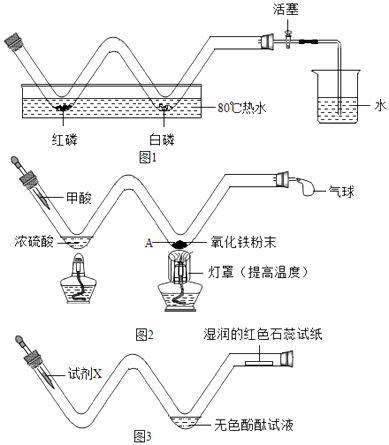
①燃烧条件的探究:在如图1所示装置(省略夹持仪器,下同)中,向W形玻璃管中放入足量红磷和白磷,塞好橡皮塞,关闭活塞,然后将其放入80℃的热水中,观察到红磷不燃烧而白磷燃烧,说明可燃物发生燃烧应具备的条件是.
②空气中氧气含量的粗略测定:为减小测量误差,待火焰熄灭后,将玻璃管,再打开活塞.
①甲酸(HCOOH)在热浓硫酸的作用下,分解生成一氧化碳和水,该反应的化学方程式是.
②实验时,A处可以观察到的现象是.
向玻璃管左端加入试剂X,观察到无色酚酞试液变红,湿润的红色石蕊试纸变蓝,试剂X可能是,该装置的优点有(答1点).
【查阅资料】
①全球海水中含有的盐类总质量为5亿亿吨,其中含有的各种离子占盐类总质量的百分含量如下表所示:
离子 | Cl﹣ | Na+ | Mg2+ | Ca2+ | K+ | 其他 |
含量 | 55.06% | 30.61% | 3.69% | 1.15% | 1.10% | … |
②工业生产中海水或卤水(海水晒盐后的剩余溶液)都可以作为制取氯化镁的原料.
【交流讨论】
同学们经讨论,一致选择卤水用于实验室制取氯化镁.你认为他们的理由是.
同学们设计如图所示方案,从卤水中制取氯化镁.
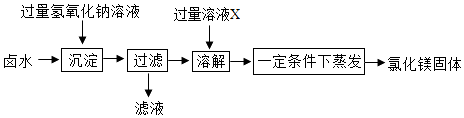
①溶液X的名称是.
②部分同学认为上述制取方案不够完善,在“过滤”操作后缺少“洗涤”操作,从而导致制取的氯化镁不纯,可能混有的杂质是.
同学们设计如下实验方案对制得的氯化镁进行纯度测定.
【实验步骤】
①称取9.5g氯化镁样品,放于烧杯中,加足量的水溶解,形成溶液;
②向上述溶液中加入90g质量分数为10%的氢氧化钠溶液;
③充分反应后,过滤;
④…
⑤向所得溶液中加入几滴无色酚酞试液,溶液变红,再逐滴加入10%稀硫酸(密度为1.07g•mL﹣1),并,当观察到溶液恰好褪色且30s内红色不复现,停止加入稀硫酸;
⑥计算氯化镁样品的纯度.
①为计算出氯化镁样品的纯度,除上述数据外,实验还需测量的数据是.
②若缺少步骤④,则会导致氯化镁纯度测定不准确,步骤④的操作是.