说起二氧化硫(SO2),你可能首先想到它是空气质量播报中提及的大气污染物.其实你真的了解SO2吗?难道它只是有害物质吗?
SO2与食品工业
SO2作为防腐剂、漂白剂和抗氧化剂广泛用于食品行业.葡萄酒酿制中适量添加SO2 , 可防止葡萄酒在陈酿和贮藏过程中被氧化,抑制葡萄汁中微生物的活动.食糖加工过程中可使用SO2进行脱色.按照我国《食品添加剂使用标准(GB2760﹣2014)》,合理使用SO2不会对人体健康造成危害.
标准中部分食品SO2的最大残留量
食品 | 蜜饯 | 葡萄酒 | 食糖 | 水果干 | 巧克力 | 果蔬汁 |
最大残留量 | 0.35g/kg | 0.25g/L | 0.1g/kg | 0.1g/kg | 0.1g/kg | 0.05g/kg |
SO2与硫酸工业
硫酸是重要的化工原料,工业制硫酸的关键步骤是SO2的获取和转化.工业利用硫制硫酸的主要过程示意如下:

硫酸工业的尾气中含有少量SO2 , 若直接排放会污染空气,并导致硫酸型酸雨.工业上可先用氨水吸收,再用硫酸处理,将重新生成的SO2循环利用.
SO2与化石燃料
化石燃料中的煤通常含有硫元素,直接燃烧会产生SO2 . 为了减少煤燃烧产生的SO2污染空气,可以采取“提高燃煤质量,改进燃烧技术”的措施,例如,对燃煤进行脱硫、固硫处理;还可以采取“优化能源结构、减少燃煤使用”的措施,例如,北京大力推广的“煤改气、煤改电”工程,有效改善了空气质量.
现在,你对SO2一定有了新的认识,在今后的化学学习中你对SO2还会有更全面的认识!
依据文章内容回答下列问题.
如图所示进行实验,受热分解的化学方程式为,3.16g KMnO4产生O2的质量为g.
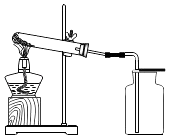
【查阅资料】KMnO4溶液呈中性、有腐蚀性
【进行实验】
实验1:将新鲜鸡皮在不同浓度的KMnO4溶液中浸泡相同时间,现象如表
KMnO4溶液浓度 | 0.002% | 0.01% | 0.1% | 1% |
鸡皮的变化 | 无明显变化 | 边缘部分变为棕黄色 | 全部变为棕色 | 全部变为黑色 |
实验2:将铜片分别浸泡在4种浸泡相同时间,现象如下表.
编号 | ① | ② | ③ | ④ | |
实验 |
25mL0.1%KMnO4溶液 |
25mL0.1%KMnO4溶液+10滴浓硫酸 |
25mL蒸馏水+10滴浓硫酸 |
25mL1%KMnO4溶液+10滴浓硫酸 | |
铜片 质量/g | 实验前 | 0.54 | 0.54 | 0.54 | 0.54 |
18小时后 | 0.54 | 0.52 | 0.54 | 0.43 | |
【解释与结论】
实验1的目的是
5Cu+2KMnO4+8H2SO4=5CuSO4+2MnSO4+K2SO4+.