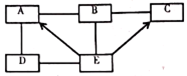
稀释浓硫酸
B .
稀释浓硫酸
B .  用氯化钠固体配制氯化钠溶液
C .
用氯化钠固体配制氯化钠溶液
C .  蒸发氯化钠溶液
D .
蒸发氯化钠溶液
D .  用pH试纸测定溶液的酸碱度
用pH试纸测定溶液的酸碱度

|
检测次数 |
溶液中检测出的物质 |
|
第一次 |
KCl、K2SO4、Na2SO4、NaCl |
|
第二次 |
KCl、BaCl2、Na2SO4、K2SO4 |
|
第三次 |
Na2SO4、KCl、K2CO3、NaCl |
提出假设:烧碱溶液也能与CO2发生反应。
设计方案:
①制取CO2气体;
a.化学反应原理(用化学方程式表示):。
b.请你从图中,选出正确的发生装置(填字母),选择该装置的理由是。往装置中加药品前一定要。
A  B
B  C
C  D
D 
②组装实验装置:(除需要烧碱溶液外)还应选择下列装置中的。(填字母)
A  B
B  C
C  D
D  E
E 
③验证假设进行实验:
| 实验步骤 | 实验现象 | 结论 |
| 向装有CO2的瓶中注入少量NaOH溶液后, 立即连接实验所选装置,振荡反应容器 |
| 提出的假设(填 “成立“或”不成立“) |
④反思与应用:a.本实验从反应物的角度,利用的改变验证了反应的发生。b·在实验室中,久置的烧碱溶液会变质,其原因是(写化学方程式)。因此,烧碱溶液应保存。
(实验探究1)甲组同学在烧杯中加入10mL稀硫酸。滴入几滴酚酞试液,接着分两次向烧杯中滴入氢氧化钠溶液。第一次滴加几滴氢氧化钠溶液后,不断搅拌,第二次继续滴加氢氧化钠溶液至过量。则第一次滴加氢氧化钠溶液时,溶液中溶质(不考虑酚酞)的质量变化情况是;第二次滴加氢氧化钠溶液时观察到的现象是。由上述实验甲组同学得出了稀硫酸与氢氧化钠溶液能发生反应的结论。反应的化学方程为。
(实验探究2)同学们想要利用找到的生锈的铁钉继续探究,并设计了如下实验方案。
乙组同学的实验过程如图所示:向a试管中滴加氢氧 化钠溶液时无明显现象,再将混合后的溶液倒入盛有生锈铁钉的另一试管中,观察到的明显现象。
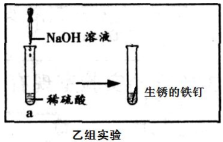
乙组结论:生锈的铁钉可以证明稀硫酸与氢氧化钠溶液能发生反应。
丙组同学的实验过程与乙组相同,但是丙组同学却未观察到明显现象。
丙组结论:生锈的铁钉可以证明稀硫酸与氢氧化钠溶液能发生反应。

结论一:K2SO4 结论二:K2SO4、H2SO4 结论三:
丙同学设计实验,用两种方法验证结论三正确:
实验操作 | 实验现象 | 实验结论 |
方法一:取C中溶液少许,加入足量的BaCl2溶液 | 产生白色沉淀 | 结论三正确 |
方法二:取C中溶液少许,加入适量的 | 产生气泡 |
乙同学对方法一提出质疑,认为方法一错误,理由是。
(提出问题)反应后的无色溶液中含有那些溶质?
(猜想与假设)甲同学猜想:溶液中只含有NaOH一种溶质
乙同学猜想:溶液中含有NaOH、Na2CO3和Ca(OH)2两种溶质
丙同学猜想:溶液中含有NaOH、Ca(OH)2
取少量溶液于试管中,向其中通入适量二氧化碳,若无明显现象即可得出自己猜想正确的结论,请对甲同学的实验设计是否合理进行评价。
图甲 
图乙