试回答(填序号):能导电的是;属于电解质的是。

a.SO2
b.NOx
c.VOCs
d. NH3

|
SO2性质梳理 |
化学方程式 |
|
|
物质类别 |
酸性氧化物 |
①SO2
+H2O |
| ②SO2 + CaO = CaSO3 | ||
| ③ | ||
| S元素 价态 | S为+4价 | ① |
| ② SO2 + 2H2S = 3S + 2H2O | ||

请判断A的化学式并说明判断理由:。
A.没有洗涤烧杯和玻璃棒
B.未等NaOH溶液冷却至室温就转移到容量瓶中定容
C.容量瓶不干燥,含有少量蒸馏水


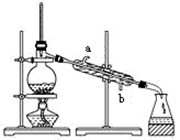
① 与研究目的直接相关的B、C中的实验现象是。
② 如果通入气体中混有SO2 , 能否看到相同的现象? (填“能”、“不能”或者“”“不能确定”),用化学方程式进行解释:
③从物质性质的方面来看,这样的实验设计还存在事故隐患,事故表现是最后缺少一个装置,用化学方程式解释其原理