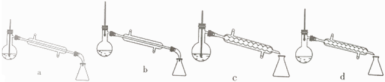
A | B | C | D |
|
|
|
|
制取SO2 | 制取NO2 | H2C2O4·2H2O分解 | 分离苯与溴苯 |
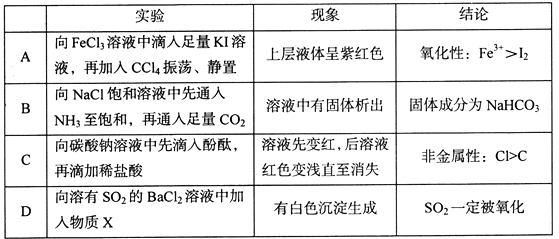
选项 | 实验操作 | 实验现象 | 解释或结论 |
A | 将相同大小的金属钠分别投入乙醇和水中 | 乙醇与钠反应缓慢,水与钠反应剧烈 | 乙醇羟基中的氢原子不如水分子中的氢原子活泼 |
B | 向 2 mL 1 mol/L NaOH 溶液中先加入3滴 1 mol/L MgCl2 , 再加入3滴 1 mol/LFeCl3 溶液 | 先生成白色沉淀,后生成红褐色沉淀 | 证明 Ksp[Mg(OH)2]>Ksp[Fe(OH)3] |
C | 将水蒸气通过灼热的铁粉 | 生成的气体可以点燃 | 铁与水蒸气在高温下发生反应 |
D | 将刚摘下的红色花朵放入盛满干燥氯气的集气瓶中,盖上玻璃片 | 花朵褪色 | 因为次氯酸具有漂白作用 |
已知:在溶液中.FeSO4+NO [Fe(NO)]SO4(棕色),该反应可用于检验NO。下列说法错误的是( )
选项 | A | B |
装 置 图 |
|
|
现象 | 右边试管产生气泡较快 | 左边棉球变棕黄色,右边棉球变蓝色 |
结论 | 催化活性:Fe3+>Cu2+ | 氧化性:Br2>I2 |
选项 | C | D |
装 置 图 |
|
|
现象 | 试管中先出现淡黄色固体,后出现黄色固体 | 试管中液体变浑浊 |
结论 | Ksp:AgCl>AgBr>AgI | 非金属性:C>Si |
实验装置 | 实验序号 | 滴管试剂 | 试管试剂 | 实验现象 |
| ① | 0.2 mol/L NaClO溶液 | 饱和Ag2SO4溶液 | 产生白色沉淀 |
② | CH3COOH溶液 | 光照管壁有无色气泡 | ||
③ | 0.2mol/LFeSO4酸性溶液和KSCN溶液 | 溶液变红 | ||
④ | 0.2mol/L的AlCl3溶液 | 产生白色沉淀 |
则以下判断错误的是( )
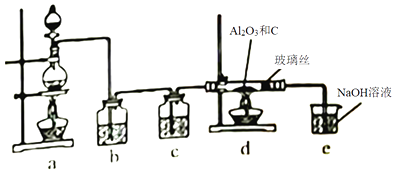
 制备氨气
B .
制备氨气
B . 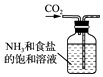 制取NaHCO3
C .
制取NaHCO3
C .  分离NaHCO3
D .
分离NaHCO3
D .  灼烧NaHCO3
灼烧NaHCO3

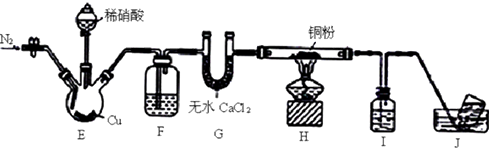
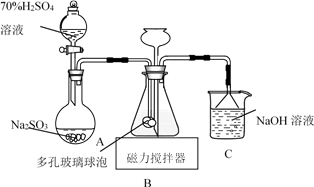
【制备NaClO溶液】实验装置如下图图甲所示(部分夹持装置已省略)
已知:3NaClO 2NaCl+NaClO3
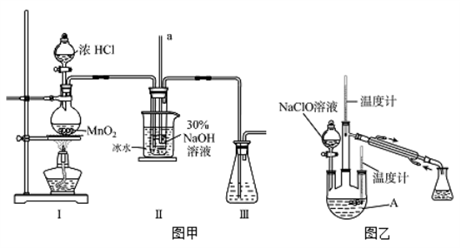
反应过程中,如果分液漏斗中溶液的滴速过快, 部分N2H4·H2O参与A中反应并产生大量氮气,产品产率因此降低,请写出降低产率的相关化学反应方程式;充分反应后,加热蒸馏A内的溶液即可得到水合肼的粗产品。
①滴定时,可以选用的指示剂为;
②实验测得消耗I2溶液的平均值为20. 00 mL,馏分中N2H4·H2O的质量分数为。
请简述理由:。
)溶液X中一定大量含有的金属阳离子是,简述如何检验溶液X中该离子。
①室温下,0.05mol/L KHC2O4溶液中,c(C2O42-)>c(H2C2O4)。滴定操作时,标准液应装在
(填仪器名称)中;滴定终点的现象为。
②气体Y中SO2的物质的量分数为。
硼酸三甲酯 | 甲醇 | |
溶解性 | 与乙醚、甲醇混溶,能水解 | 与水混溶 |
沸点/℃ | 68 | 64 |
硼酸三甲酯与甲醇混合物的共沸点为54℃ | ||
Na2B4O7·10H2O+2H2SO4+16CH3OH 2NaHSO4+4[(CH3O)3B+CH3OH]+17H2O
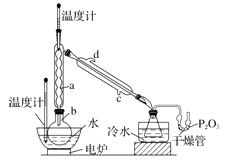
实验步骤如下:
①在圆底烧瓶中加入44.8 g 甲醇和19.1gNa2B4O7·10H2O (硼砂,式量为382),然后缓慢加入浓H2SO4 并振荡;加热烧瓶中的液体;通过分馏柱回流一段时间。
②先接收51~55℃的馏分,再接收55~60℃的馏分。
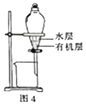
③将两次馏分合并,加入氯化钙进行盐析分层,上层为硼酸三甲酯,分离。
④精馏得高纯硼酸三甲酯19.2 g。
回答下列问题: