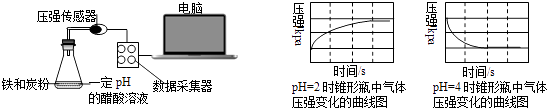
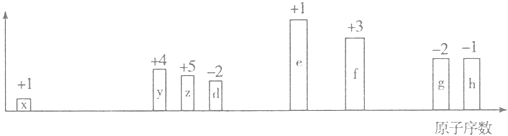
根据判断出的元素回答问题:
除去Fe2+和Fe3+并制备CuSO4•5H2O,请根据以下流程回答问题:
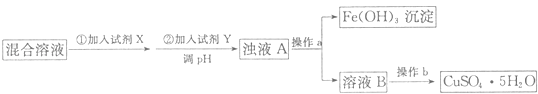
有关氢氧化物开始沉淀和沉淀完全的pH如下表:
氢氧化物 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 |
开始沉淀的pH | 1.9 | 6.5 | 4.7 |
沉淀完全的pH | 3.7 | 9.7 | 6.7 |
①试剂X的化学式为,加入试剂Y调节溶液pH的范围是;
②操作a用到的玻璃仪器为烧杯,玻璃棒和;操作b的名称为;
已知:5Fe2++MnO4﹣+8H+=5Fe3++Mn2++4H2O,欲测定混合溶液中的Fe2+的浓度,取待测液20.00mL,用浓度为0.01mol•L﹣1的酸性KMnO4溶液滴定,下列滴定方式中,最合理的是(填字母序号,夹持部分已略去)
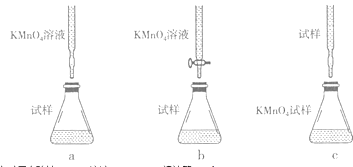
达到终点时用去酸性KMnO4溶液12.00mL,请计算c(Fe2+)=.
O2NC6H4COOC2H5+OH﹣⇌O2NC6H4COOO﹣+C2H5OH
两种反应物的初始浓度均为0.050mol•L﹣1 , 某温度下测得O2NC6H4COOC2H5的转化率α随时间变化的数据如下表所示:
t/s | 0 | 120 | 180 | 240 | 330 | 530 | 600 | 700 | 800 |
α/% | 0 | 33 | 42 | 49 | 59 | 73 | 74 | 75 | 75 |
回答下列问题:①该反应在330s~530s的平均反应速率为(只列算式,不做运算)
②为提高O2NC6H4COOC2H5的转化率,可以采取的措施有. (写1条即可)
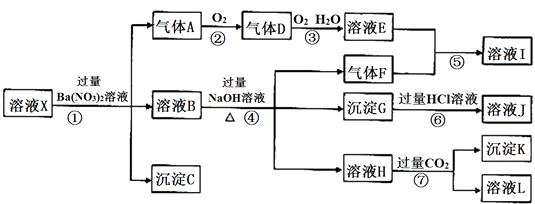
依据以上信息,回答下列问题: