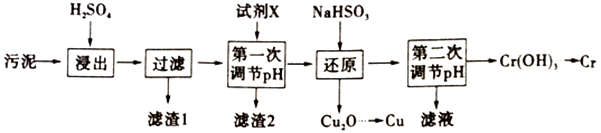
请回答下列问题:
已知部分物质沉淀的pH及CaSO4的溶解度曲线如下:
①处理时,水样应先酸化,最好选用(选填“稀硝酸”、“稀硫酸”或“稀盐酸”)酸化。
②在该条件下,Cr2O72-最终转化为Cr3+、取水样100mL,处理该水样时消耗了10mL0.025 mol·L-1 K2Cr2O7溶液。则该水样的COD为 mg·L-1。
已知:N2(g)+O2(g)=2NO(g) △H=+180.5kJ•mol-1
2C(s)+O2(g)=2CO(g) △H= -221.0kJ•mol-1
C(s)+O2(g)=CO2(g) △H= -393.5 kJ•mol-1
则分析反应2NO(g)+2CO(g)=N2(g)+2CO2(g)的△H= kJ•mol-1。
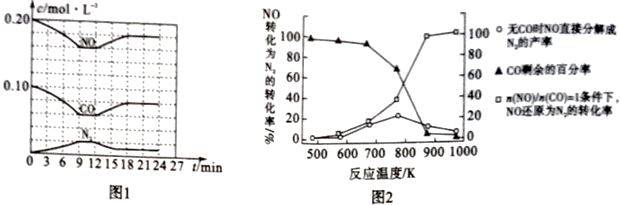
①计算反应在第9-12 min时的平衡常数K=。
②第12 min时改变的反应条件可能是(任写一条)。
①若不使用CO,发现当温度超过775 K时,NO的分解率降低,其可能的原因是。
②在n(NO)/n(CO) =1的条件下,为更好地除去NO,应控制的最佳温度应在 K左右。
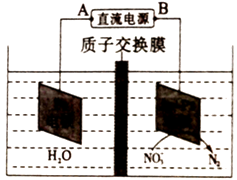
①该配合物中含有化学键有(填字母编号)。
A.离子键 B.极性共价键 C.非极性共价键 D.配位键 E.金属键
②配体乙二胺分子中氮原子、碳原子轨道的杂化类型分别为、。
③乙二胺和三甲胺[N(CH3)3]均属于胺,且相对分子质量相近,但乙二胺比三甲胺的沸点高得多,原因是。
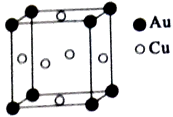

已知以下信息:
①A的相对分子质量为58,含氧的质量分数为0.552,已知核磁共振氢谱显示为一组峰,可发生银镜反应。
② ![]()
③R—COOH R—COCl
④ 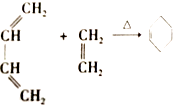
⑤ 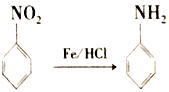
请回答下列问题:
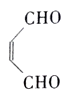 的合成路线。
的合成路线。
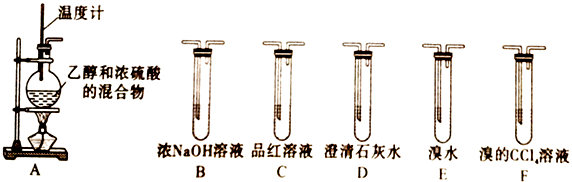
请回答下列问题:
探究设计1:若要检验A中所得气体含有SO2 , 可将混合气体直接通入(填装置代号,下同)装置;若要检验A中所得气体含有乙烯,可将混合气体直接通入。
①设计2中①→②→③装置对应的装置分别是(填装置代号)。
②设计2中能说明二氧化硫气体存在的现象是。
③使用装置②的目的是。使用装置③的目的是。
④设计2中确认乙烯气体存在的现象是。
探究设计3:若要一次性将乙烯、CO2、SO2三种气体全部检验出来,气体被检验出来的先后顺序是,气体通过装置的顺序为A→(填装置代号)。