用如图所示装置验证反应产物二氧化碳
B .
用如图所示装置验证反应产物二氧化碳
B .  用如图装置吸收氨气并防止倒吸
C .
用如图装置吸收氨气并防止倒吸
C .  如图装置配制100 mL 1 mol•L﹣1的硫酸
D .
如图装置配制100 mL 1 mol•L﹣1的硫酸
D .  用如图装置除去氯气中的氯化氢
用如图装置除去氯气中的氯化氢

①写出氯化钠电解槽内发生反应的离子方程式:.
②写出ClO2发生器中的化学方程式,并标出电子转移的方向及数目:.
③ClO2能将电镀废水中的CN﹣离子氧化成两种无毒气体,自身被还原成Cl﹣ . 写出该反应的离子方程式.

已知:过滤(Ⅱ)所得滤液是MnSO4、ZnSO4、Fe2(SO4)3、Al2(SO4)3的混合液.相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0mol•L﹣1计算)如下表:
沉淀物 | Fe(OH)3 | Al(OH)3 | Zn(OH)2 | Mn(OH)2 |
开始沉淀时的pH | 2.7 | 4.0 | 6.4 | 7.7 |
完全沉淀时的pH | 3.7 | 5.2 | 8.0 | 10.4 |
A.MnCO3 B.Na2CO3 C.Zn2(OH)2CO3 D.NH3•H2O

4Fe(s)+3O2(g)═2Fe2O3△H=﹣1648kJ•mol﹣1
C(s)+O2(g)═CO2(g)△H=﹣393kJ•mol﹣1
2Fe(s)+2C(s)+3O2(g)═2FeCO3(s)△H=﹣1480kJ•mol﹣1
写出FeCO3在空气中灼烧生成Fe2O3的热化学方程式:.
①称取12.125g样品,加盐酸完全溶解后,配成250.00mL溶液A.
②量取25.00mL溶液A,加入足量的KI,再用0.2500mol•L﹣1Na2S2O3溶液滴定生成的I2(反应原理为I2+2Na2S2O3=2NaI+Na2S4O6),消耗30.00mL Na2S2O3溶液至终点.
③另取50.00mL溶液A,加入足量BaCl2溶液充分反应后,过滤,将所得沉淀洗涤、干燥后,称得其质量为2.330g.
化学键 | C﹣H | C﹣F | H﹣F | F﹣F |
键能/(kJ•mol﹣1) | 414 | 489 | 565 | 155 |
①某燃料电池以二甲醚为原料,熔融碳酸盐为电解质,其负极反应如下:CH3OCH3+6CO ﹣12e﹣=8CO2+3H2O.写出该燃料电池的正极反应式:.
②废水中含甲醇对水质会造成污染,Co3+可将甲醇氧化为CO2 . 某同学以Pt作电极电解酸性含甲醇废水与CoSO4混合液模拟工业除污原理,其阳极反应式为.
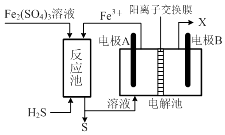
①电解池中电极A、B均为惰性电极,其中A为电解池的极;电极B所得到的物质X的分子式为.
②反应池中发生的离子反应方程式为.