硼酸三甲酯 | 甲醇 | |
溶解性 | 与乙醚、甲醇混溶,能水解 | 与水混溶 |
沸点/℃ | 68 | 64 |
硼酸三甲酯与甲醇混合物的共沸点为54℃ | ||
Na2B4O7·10H2O+2H2SO4+16CH3OH 2NaHSO4+4[(CH3O)3B+CH3OH]+17H2O
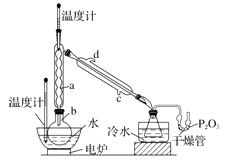
实验步骤如下:
①在圆底烧瓶中加入44.8 g 甲醇和19.1gNa2B4O7·10H2O (硼砂,式量为382),然后缓慢加入浓H2SO4 并振荡;加热烧瓶中的液体;通过分馏柱回流一段时间。
②先接收51~55℃的馏分,再接收55~60℃的馏分。
③将两次馏分合并,加入氯化钙进行盐析分层,上层为硼酸三甲酯,分离。
④精馏得高纯硼酸三甲酯19.2 g。
回答下列问题:
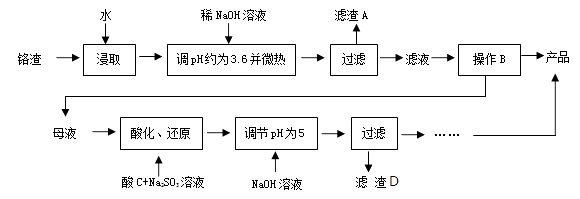
已知:Fe3+、Cr3+完全沉淀(c≤1.0×10-5mol·L-1)时pH分别为3.6和5。
回答下列问题:
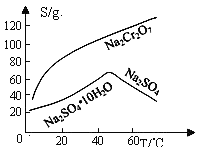
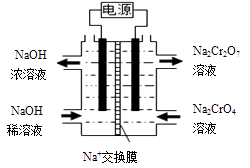
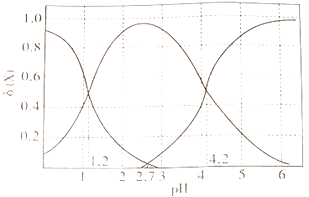
①当溶液中含碳粒子的主要存在形态为C2O42-时,溶液的酸碱性为(填标号)。
A.强酸性
B.弱酸性
C.中性
D.碱性
②25℃时,反应C2O42-+H2C2O4- 2HC2O4-的平衡常数的对数值1gK=。
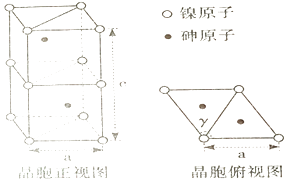
①镍原子配位数为,配原子构成的几何体是。
②该晶体密度的计算式为g·cm-3。
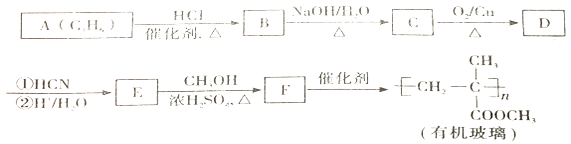
已知:羰基化合物可发生以下反应:
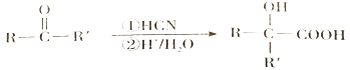
(注:R'可以是烃基,也可以是H 原子)
回答下列问题:
①能与饱和NaHCO3 溶液反应产生气体 ②能使Br2的四氯化碳溶液褪色
其中核磁共振氢谱显示为3 组峰,且峰面积比为6∶1∶1的结构简式为。